-
2016年中國醫藥行業市場運營現狀分析
2016/5/25 11:06:10 來源:中國產業發展研究網 【字體:大 中 小】【收藏本頁】【打印】【關閉】
核心提示:一、“供給側”矛盾重災區,藥品領域亟待改革“十一五”以來,我國醫藥工業總產值年均增長超過23%,保持了良好增長態勢,整體規模在2015 年達到全球第二,預計2020 年之前將進一步增長并與一、“供給側”矛盾重災區,藥品領域亟待改革
“十一五”以來,我國醫藥工業總產值年均增長超過23%,保持了良好增長態勢,整體規模在2015 年達到全球第二,預計2020 年之前將進一步增長并與美國并列成為全球第一水平。然而與此同時,我國藥品領域“供給側”矛盾突出,主要體現在細分產品市場供需關系均未達到均衡。一方面,高端的好藥新藥嚴重不足,不能滿足國民的需求,需要大量進口。另一方面,低端的仿制藥大量過剩,供給遠遠超出市場總需求。
(1)藥品行業總體穩步增長
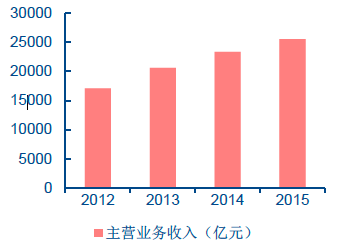
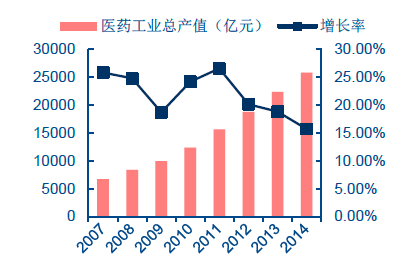
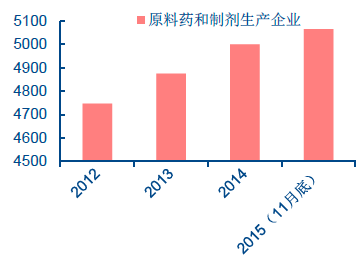
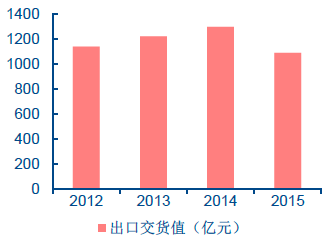
我國醫藥制造業主營業務收入近年來呈穩定增長趨勢。根據我國國家食品藥品監督管理總局(China Food and Drug Administration,簡稱CFDA)的數據,2007-2014 年間,我國醫藥工業總產值從6719 億元增長到2.57 萬億元,連續保持15%以上的年增長率。2015 年前10 個月出口交貨量1089 億元,同比增長4.15%。截至2015 年11 月底,全國共有原料藥和制劑生產企業5065 家,近年來企業數量也在逐步增長。
2012-2015 年醫藥制造業主營業務收入
我國醫藥工業總產值及增長率
全國原料藥和制劑生產企業數量
2012-2015 年醫藥制造業出口交貨值
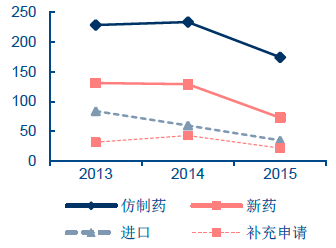
近年來,我國CFDA 審批通過的藥品數量呈現化藥逐年下降、中藥增速明顯、生物制品基本持平的趨勢,2015 年CFDA 審批通過了310 個化藥、148 個中藥、26 個生物制品,而2013-2014 年化藥審批通過水平一直維持在450 以上的水平,中藥審批通過數量沒有超過50。近三年來,通過審批的仿制藥一直占據化藥審批通過藥品的半壁江山。
2013-2015 年藥品批準上市受理號數量
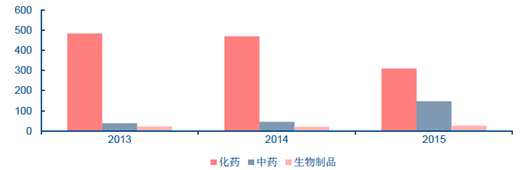
2013-2015 年化藥批準上市數量分布
2013-2015 年中藥批準上市數量分布
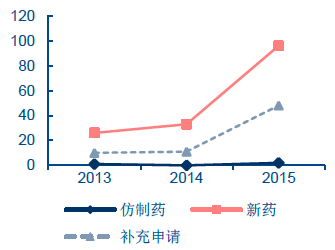
二、上市藥品規模雖大但總體質量不高
1998 年之前,我國沒有嚴格的藥品審評審批制度,中央和地方都可以批準藥品生產,批準文號眾多,產品混亂,其中大部分藥未經過三期臨床驗證或質量一致性評價就可以生產上市。1998 年國家藥品監督管理局成立,開展了批準文號清理工作,建立了全國統一的藥品序列(即國藥準字號)體系。但由于清理工作把關不嚴,一些沒有臨床價值的獲批藥品從 “地標”轉為“國標”。
2007 年國家食品藥品監督管理局局務會審議通過了新的《藥品注冊管理辦法》。根據國務院研究室綜合司巡視員范必發表的文章,目前我國有藥品批準藥號18.9 萬個,其中有16.8萬個藥號是2007 年以前審批的,后轉為國家認可的國藥準字號,存在一定的安全隱患:大部分中成藥都是以低于化學藥的審評標準獲得生產許可,藥理毒理機制較不清晰;仿制藥主要從化學成分上做到與原研藥相同。2007 年以后批準了2.1 萬個藥號中,雖這一階段已進一步嚴格了藥品審批管理,但由于此前基礎薄弱,目前我國上市藥品整體質量依然不高。
普通藥品存在大量低水平重復建設
藥品名稱國產藥品藥號批準數進口藥品藥號批準數藥品廣告批準數維生素C片116804復方磺胺甲惡唑片97200對乙酰氨基酸片945020鹽酸小檗堿片94002板藍根顆粒845068維生素B1片74000諾氟沙星膠囊723010復方丹參片685024紅霉素腸溶片66500維生素C注射液66300近年來,我國食品安全監管工作得到很大加強,但是我國上市藥品的總體質量與發達國家相比仍處于落后地位。目前中國近18.9 萬個藥品批準藥號中95%以上均為仿制藥,存在大量低水平重復建設,如表1 所示單是維生素C 片就有1168 種國產藥品。國家食品藥品監管總局副局長吳湞在相關國務院新聞發布會答記者問時直言,“目前我國仿制藥整體水平不高,準入門檻不高,企業快速發展的同時,產業基礎又比較薄弱,藥品低水平重復現象比較嚴重。”我國現在已經是全球第二大藥品市場,但國際競爭不足,大部分企業沒參加到國際競爭之中。2009 年出版的世界衛生組織統計年鑒顯示,中國進入世衛組織采購目錄的品種數量為6 個,印度則是194 個,遠超中國。這一巨大差距的重要原因之一就是中國大多數仿制藥的質量達不到世衛組織的要求。根據醫學界的報道,食藥監總局藥品認證管理中心處長李正奇曾撰文表示,國產仿制藥總體質量比原研藥相差遠,有的甚至是安全的無效藥。
三、高端的好藥新藥嚴重不足
高端藥品的供給嚴重不足主要體現在國內創新能力缺乏和國外藥物引進困難兩個方面。中國藥品創新研發能力嚴重落后。我國完全擁有自主知識產權的創新藥只有30 余種,在中國批準上市并得到國際認可的只有7 個。國產一類新藥僅123 個,化學藥和生物制品最多,有118 個,而中成藥僅5 個。其中最多的是抗生素,尤其是復方抗生素。大部分我國的所謂新藥都不是世界范圍內的首發新藥,而是在國外專利尚未在國內批準前,搶注“專利”獲得一類藥身份的。
2011-2015 年美國FDA 新藥獲批數量
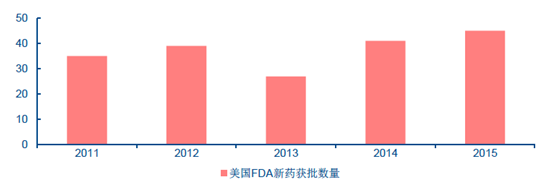
而發達國家的新藥研發能力非常強勁。美國藥品行業和企業受食品藥品管理局(Foodand Drug Administration,簡稱FDA)監管,FDA 僅2015 年一年就受理批準了45 個新藥,包括33 個新分子實體(NME)和12 個生物制品許可申請(BLA)。2013 年和2014 年,FDA新批新藥數目分別為27 個和41 個,多年以來維持在高位水平。另外,美國FDA 批準的新藥中基本上都是全球范圍的新藥,例如2013 年的27 個新藥中有20 個新藥是全球首次上市的新藥,首次上市的比例高達74%。再例如歐洲,2010-2014 年,歐洲藥品管理局(EMA)發放新藥上市許可申請達355 個。
我國自主研發生產的創新藥嚴重缺乏的主要原因是,藥品領域的研發投入不足。國際上大型醫藥跨國公司的研發投入占銷售收入的16%左右,而我國藥品企業約占4-5%。目前從全球范圍看,隨著生物制劑產業發展,新分子化合物逐步退出藥品研發熱點,國際大型藥企的研發圍繞生物制劑展開,研發成本進一步提高。以美國醫藥公司的研發投入為例,2015年輝瑞公司的研發投入占銷售收入比為15.7%、羅氏為19.4%、強生為12.9%。2014 年,我國67 家上市制藥企業公布了研發投入,總共53.56 億元,不到9 億美元。羅氏公司一年的科研投入都可以超過這67 家國內藥企。
2015 年全球銷售收入前十醫藥公司研發投入情況
排名名稱2015年收入(億美元)2015年研發投入(億美元)研發占銷售收入比(%)1強生700.7490.4612.912諾華494.1489.3518.083輝瑞488.5176.915.744羅氏481.4593.3219.385默沙東394.9867.0416.976葛蘭素史克366.0254.4714.887吉利德326.3930.149.238阿斯利康247.0856.0322.689艾伯維228.5942.8518.7510安進216.6240.718.79國際上最新藥物進入中國時間間隔較長。根據目前我國藥品政策規定,進口藥進入中國上市時要在中國重新進行臨床試驗,這也是為什么以前“世界新”的藥品進入我國所需時間長。影響中國公眾健康的幾類重要疾病,如心血管病、惡性腫瘤、傳染病等,國外不斷有重大突破,但這些成果不能及時應用到臨床,不僅延誤了患者治療,而且在一定程度上增加了醫保負擔。
推廣療效確切的新藥,可以有效提高健康水平,降低醫療成本。據美國統計,使用一種新藥,可以為每位患者每年降低醫療費用89 美元。現在,中國患者不但享受不到世界先進的醫療成果,還要付出較高的經濟代價。比如癌癥中唯一實現突破的宮頸癌疫苗,2006 年即在美國上市,隨后陸續登陸全球100 多個國家和地區,包括中國的香港、澳門和臺灣。但由于缺乏特殊審批渠道,一直未通過中國大陸注冊。今年終于出現進展,2016 年3 月8 日,在中國癌癥基金會宮頸癌健康講座活動中,華中科技大學同濟醫學院王增珍教授告訴媒體: “今年內,宮頸癌疫苗將在國內上市。”我國每年宮頸癌新發病10 萬人,早期診治費用不足萬元,晚期高達10 萬元以上,每年有3 萬名婦女死于宮頸癌。全國每年用于宮頸癌支出醫療費億元,基本要由醫保負擔。而患病所帶來家庭情感付出和其它社會成本則無法計算。如果國內成功引進HPV 疫苗,將有效降低80-95%的患病幾率。
四、低端的仿制藥大量過剩
作為全球第二大的醫藥消費市場,目前中國近18.9 萬個藥品批準文號中95%以上均為仿制藥。目前原料藥和制劑生產企業約5000 多家,這些制藥企業擁有化藥批準文號12.2 萬個,絕大部分為仿制藥,截止2015 年底我國仿制藥市場規模約為5000 億元。目前我國是全球最大的仿制藥市場。在已批準的7000 多種化學藥品中,絕大多數是仿制藥。但是,我國藥品審評\審批過去僅重視質量的一致性,而對療效一致性的重視程度較低,且過去仿制的對象為已有國家標準的藥品,導致一代代的仿制過后,藥品的質量與原研藥間的差距越來越大,臨床的有效性也不能得到很好的保證。國際上對產自我國的仿制藥認可程度較低,公開數據顯示國產仿制藥獲得美國FDA 批準的數量極少,權威的學術刊物對使用中國仿制藥作出的研究成果往往不予發表。
2011-2013 年美國FDA 批準仿制藥中國印度對比情況
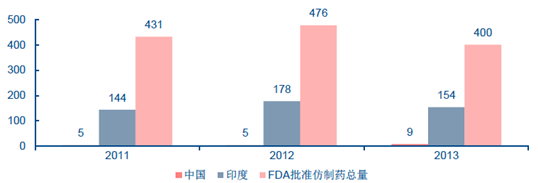
同樣作為仿制藥生產大國,印度制藥產業規模雖不如我國龐大,但含金量較我國企業高,其仿制藥在國際上的受認可程度要遠高于中國。根據Aranca 研究中心的報告,2011 年印度仿制藥市場規模達到113 億美元,占比72%,是印度制藥領域最大的版塊。近幾年印度獲批的仿制藥申請基本都占到美國食品藥品監督管理局(FDA)批準的約1/3,暫時性批準占到近40%,相比中國在FDA 獲批的仿制藥屈指可數。截止2014 年FDA 允許出口美國藥品和有關原材料的印度企業有650 家,而中國企業只有300 家。從美國仿制藥市場份額來看,印度仿制藥已經占據了美國40%以上的仿制藥市場份額,而我國由于獲批藥品種類只有個位數,在美國的仿制藥市場份額中幾乎為零。
中國與印度藥品市場對比
項目中國印度2015年藥品出口總額(億美元)5641642015年醫藥市場規模(億美元)3,922258藥品出口占市場總額比例6.95%63.57%FDA允許出口藥品和有關原材料企業300650藥品生產企業數量5,06510,563藥品種類7,000377作為世界第三大仿制藥生產大國,印度生產了全球20%的仿制藥,并使制藥業成為印度經濟的支柱之一。目前,印度藥品出口到200 多個國家,疫苗和生物制藥產品出口到150個國家。一般來說,西方國家昂貴藥品一經上市,印度制藥企業在本國專利法保護下可以仿制同類產品。這些仿制藥與專利藥在劑量、安全性、效力、適應證上幾乎相同,在印度是不受專利束縛的正規藥物。由于無需支付專利費,仿制藥的平均價格只有專利藥的20-40%,個別品種甚至相差10 倍以上。正是憑借低成本制造、雄厚的技術、大量懂英語的合格技術人員與高質量產品,印度制藥廠商總是能夠獲得大量外包生產合約。目前印度境內擁有FDA認證的藥廠共有119 家,可向美國出口約900 種獲得FDA 批準的藥物和制藥原料;擁有英國藥品管理局認證的藥廠也有80 多家。
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播更多信息之目的,如有侵權行為,請第一時間聯系我們修改或刪除,郵箱:cidr@chinaidr.com。


